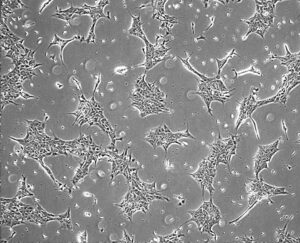
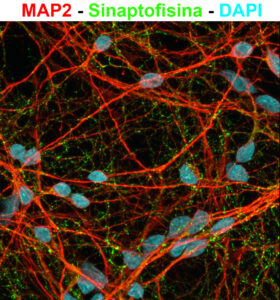
La enfermedad de Alzheimer (EA) es la principal causa de deterioro cognitivo y demencia en adultos mayores. Es una patología neurodegenerativa progresiva que no tiene tratamientos efectivos y debido a que su incidencia crece sostenidamente se la considera uno de los mayores desafíos para los sistemas de salud a nivel mundial. La EA se caracteriza por la acumulación cerebral de Amiloide beta (Aβ) y la degeneración de neuronas en áreas cerebrales relacionadas a la memoria y a otras funciones cognitivas superiores (Figura 1). El Aβ es un péptido de unos 40 aminoácidos que se origina por el metabolismo de la proteína precursora de amiloide (APP). La hipótesis dominante indica que la acumulación de Aβ desencadena el proceso neurodegenerativo y el deterioro cognitivo en la EA, sin embargo el mecanismo subyacente sigue siendo materia de intensa investigación y controversia científica. Nuestra línea de investigación busca generar nuevos conocimientos que sirvan para esclarecer el mecanismo de neurotoxicidad del Aβ. Particularmente, nos interesa determinar la participación de APP como receptor de Aβ y de la proteína heterotrimérica Go (Go) como vía de señalización que media el proceso neurodegenerativo. Para ello empleamos diversas técnicas de microscopía, de biología celular, molecular y bioquímica que permiten estudiar la interacción de APP con Go en condiciones normales y patológicas (Figura 2). En ese contexto, aprovechamos el potencial de las células madre pluripotentes inducidas (CMPi) y las técnicas de edición génica para desarrollar clones de CMPi humanas, normales y mutantes de APP (Figura 3). A partir de ello contamos con un modelo celular humano de vanguardia que permite estudiar la señalización APP-Go en neuronas humanas y así determinar su asociación con el proceso neurodegenerativo en la AE (Figuras 4 y 5). Nuestros estudios buscan identificar la potencialidad de la vía APP-Go como blanco molecular para desarrollar terapias para la EA.



FONDOS CONCURSABLES DE INVESTIGACIÓN
- 2019-2023 Subsidio de la ANPCyT PICT2018-02097. Diseño de herramientas moleculares terapéuticas para la enfermedad de Alzheimer. IR.
- 2022-2025 Grant from Alzheimer’s Association Research Grant to Promote Diversity (AARGD-22-926476) Strategies disrupting the feed-forward mechanism of Aß production. PI. Dra Elena A Bignante – Co-Pi: Alfredo Lorenzo
PUBLICACIONES (ÚLTIMOS CINCO AÑOS)
- de Olmos S and Lorenzo A. Developing the theory of the extended amygdala with the use of the cupric-silver technique. Journal of the History of the Neurosciences (NJHN)- DOI: 10.1080/0964704X.2022.2133569
- Antonino M, Marmo P, Freites CL, Quassollo G, Sanchez MF, Lorenzo A*, Bignante EA* (2022) Aβ promotes amyloidogenic processing of APP and intracellular accumulation of Aβ42 through Go/Gβγ signaling. Front Cell Develop Biol, april 22, vol 10, art 852738, https://doi.org/10.3389/fcell.2022.852738 (IF2021-22: 6.68)
- Magdalena Antonino, Paula Marmo, Carlos Leandro Freites, Gonzalo Quassollo, Maria Florencia Sanchez, Alfredo Lorenzo*, Elena Anahí Bignante* (2021). Aβ promotes amyloidogenic processing of APP through a Go/Gβγ signaling. bioRxiv https://doi.org/10.1101/2021.03.10.434768 (una versión modificada de este trabajo se publicó posteriormente en Front Cell Develop Biol)
- Sigwald EL, de Olmos S, Lorenzo A. (2020) Retrograde and anterograde contextual fear amnesia induced by selective elimination of layer IV-Va neurons in the granular retrosplenial cortex (A29). Neurobiol. Learn Mem 2020 Apr 11:107229. doi: 10.1016/j.nlm.2020.107229
- Sigwald EL, Bignante EA, de Olmos S, Lorenzo A. (2019) Fear-context association during memory retrieval requires input from granular to dysgranular retrosplenial cortex. Neurobiol. Learn Mem 2019 Sep;163:107036. doi: 10.1016/j.nlm.2019.107036.
- Lista completa y actualizada disponible aquí.








